1. KVANTITATIV SAMMANSÄTTNING
Efter att innehållet i de två sektionerna har blandats består den binära blandningen, för alla tillgängliga påsstorlekar, av följande:
Clinimix N9G15E
| 1 l | 1,5 l | 2 l |
Kväve (g) | 4,6 | 6,8 | 9,1 |
Aminosyror (g) | 28 | 41 | 55 |
Glukos (g) | 75 | 113 | 150 |
Kalorier totalt (kcal) | 410 | 615 | 820 |
Glukoskalorier (kcal) | 300 | 450 | 600 |
Natrium (mmol) | 35 | 53 | 70 |
Kalium (mmol) | 30 | 45 | 60 |
Magnesium (mmol) | 2,5 | 3,8 | 5,0 |
Kalcium (mmol) | 2,3 | 3,4 | 4,5 |
Acetat (mmol) | 50 | 75 | 100 |
Klorid (mmol) | 40 | 60 | 80 |
Fosfat som HPO42- (mmol) | 15 | 23 | 30 |
pH | 6 |
Osmolaritet (mOsm/l) | 845 |
Clinimix N17G35E
| 1 l | 1,5 l | 2 l |
Kväve (g) | 8,3 | 12,4 | 16,5 |
Aminosyror (g) | 50 | 75 | 100 |
Glukos (g) | 175 | 263 | 350 |
Kalorier totalt (kcal) | 900 | 1350 | 1800 |
Glukoskalorier (kcal) | 700 | 1050 | 1400 |
Natrium (mmol) | 35 | 53 | 70 |
Kalium (mmol) | 30 | 45 | 60 |
Magnesium (mmol) | 2,5 | 3,8 | 5,0 |
Kalcium (mmol) | 2,3 | 3,4 | 4,5 |
Acetat (mmol) | 75 | 113 | 150 |
Klorid (mmol) | 40 | 60 | 80 |
Fosfat som HPO42- (mmol) | 15 | 23 | 30 |
pH | 6 |
Osmolaritet (mOsm/l) | 1625 |
2. DOSERING OCH ADMINISTRERINGSSÄTT
Administrera endast läkemedlet efter det att den icke-permanenta förslutningen mellan de två sektionerna har brutits och innehållet i de två sektionerna har blandats.
Dosering och infusionshastighet
Doseringen bör individualiseras baserat på patientens närings-/vätskebehov, energiförbrukning, klinisk status, kroppsvikt och förmåga att metabolisera Clinimix beståndsdelar, samt på ytterligare energi eller protein som ges oralt/enteralt. Dagsbehovet av vätska, kväve och energi minskar kontinuerligt med ökad ålder.
För vuxna varierar behovet från 0,16 g kväve/kg/dygn (ungefär 1 g aminosyra/kg/dygn) till 0,32 g kväve/kg/dygn (ungefär 2 g aminosyra/kg/dygn).
För småbarn varierar behovet från 0,16 g kväve/kg/dygn (ungefär 1,0 g aminosyra/kg/dygn) till 0,40 g kväve/kg/dygn (ungefär 2,5 g aminosyra/kg/dygn).
Hos vuxna och patienter 12–18 år gamla, varierar kaloribehovet från 25 kcal/kg/dygn till 40 kcal/kg/dygn, beroende på patientens näringsstatus och graden av katabolism. Patienter under 12 år kan ha större behov.
Kliniska situationer kan finnas där patienter behöver näringsämnen i mängder som varierar från Clinimix sammansättning. I en sådan situation måste man ta i beaktning att en justering av volymen (dosen) också resulterar i att doseringen av de andra näringskomponenter i Clinimix också ändras. Infusionshastigheten och volymen bör bestämmas av rådgivande läkare med erfarenhet av pediatrisk parenteral nutrition och intravenös vätskebehandling.
Denna produkt innehåller inte aminosyrorna cystein och taurin, vilka anses nödvändiga för nyfödda och spädbarn.
Detta läkemedel rekommenderas inte för prematura barn, nyfödda barn eller barn under 2 år.
Administreringshastigheten skall anpassas enligt doseringen, egenskaperna för den infunderade blandningen, den totala volymtillförseln per 24 timmar och infusionens varaktighet.
Clinimix N9G15E
Infusionstiden ska inte underskrida 8 timmar. Normalt ökas flödeshastigheten gradvis under den första timmen utan att överskrida 3 ml per kilogram kroppsvikt per timme och den maximala dosen är 40 ml per kilogram kroppsvikt per dag.
Clinimix N17G35E
Infusionstiden ska inte underskrida 8 timmar. Normalt ökas flödeshastigheten gradvis under den första timmen utan att överskrida 1,4 ml per kilogram kroppsvikt per timme och den maximala dosen är 30 ml per kilogram kroppsvikt per dag.
Administreringssätt
Vid användning för att behandla nyfödda och barn under 2 års ålder ska lösningen (i påsar och administreringsset) skyddas från ljusexponering fram till dess att administreringen är avslutad.
Administreringsväg
Valet av perifer eller central ven beror på blandningens slutliga osmolaritet. Den allmänt accepterade gränsen för perifer infusion är ungefär 800 mOsm/l men den varierar betydligt med patientens ålder och allmäntillstånd och de perifera venernas egenskaper.
3. VARNINGAR OCH FÖRSIKTIGHET
VARNINGAR
Överkänslighets- infusionsreaktioner inkluderande hypotoni, hypertoni, perifer cyanos, takykardi, dyspné, kräkningar, illamående, urtikaria, hudutslag, pruritus, erytem, hyperhidros, pyrexi och frossa har rapporterats med Clinimix.
Anafylaxi har rapporterats med andra produkter för parenteral nutrition.
Särskild klinisk övervakning krävs vid början av en intravenös infusion. Om några onormala tecken eller symtom på till exempel överkänslighets- eller infusionsreaktion utvecklas måste infusionen avbrytas omedelbart.
Lösningar som innehåller glukos ska användas med försiktighet, om överhuvudtaget, hos patienter med känd allergi mot majs eller produkter som innehåller majs.
Pulmonära vaskulära utfällningar har rapporterats hos patienter som får parenteral nutrition. I vissa fall med fatala utfall. Överdriven tillsats av kalcium och fosfat ökar risken för utfällning av kalciumfosfat. Utfällningar har även rapporterats vid frånvaro av fosfatsalt i lösningen. Utfällningar distalt från inline filtret och misstänkta utfällningar in vivo har också rapporterats.
Vid tecken på andningssvårigheter ska infusionen avbrytas och medicinsk utvärdering påbörjas.
Utöver inspektion av lösningen, ska även infusionsaggregatet och katetern kontrolleras avseende utfällningar med jämna mellanrum.
Hos patienter äldre än 28 dagar (inkluderande vuxna) får ceftriaxon inte administreras genom samma infusionsslang (t.ex. via Y-koppling) samtidigt med intravenösa lösningar som innehåller kalcium, inklusive Clinimix. Om samma infusionsslang används för efterföljande administrering måste infusionsslangen spolas noggrant med en kompatibel vätska mellan infusionerna.
Infektion och sepsis kan uppkomma till följd av användning av intravenösa katetrar för administrering av parenterala lösningar, vid dålig skötsel av katetern eller kontaminerade lösningar. Immunsuppression och andra faktorer som hyperglykemi, undernäring och/eller underliggande sjukdomstillstånd kan göra patienten predisponerad för infektionskomplikationer.
Noggrann övervakning av symtom och laboratorietester för feber/frossa, leukocytos, tekniska komplikationer med infartsanordningen och hypergkykemi kan bidra till tidig upptäckt av infektioner.
Förekomsten av septiska komplikationer kan minskas med hjälp av ökad tonvikt på aseptiska tekniker vid placering och underhåll av katetern samt genom tillämpning av aseptiska tekniker vid beredning av näringslösningen.
Att börja ge näring till svårt undernärda patienter kan leda till återmatningssyndrom som kännetecknas av intracellulära balansförändringar av kalium, fosfor och magnesium eftersom patienten blir anabol. Tiaminbrist och vätskeretention kan också utvecklas. Dessa komplikationer kan förebyggas genom att näringsintaget övervakas noggrant och ökas långsamt, utan att man övermatar.
Hypertona lösningar kan orsaka venirritation om de infunderas i en perifer ven. Valet av perifer eller central ven beror på blandningens slutliga osmolaritet.
Den allmänt accepterade gränsen för perifer infusion är ungefär 800 mOsm/l men den varierar betydligt med patientens ålder och allmäntillstånd och de perifera venernas egenskaper.
Seriekoppla inte påsarna. Risk finns att gasemboli kan uppstå på grund av luftrester i den primära påsen.
FÖRSIKTIGHET
Allvarliga rubbningar av vätske- och elektrolytbalansen, svår vätskeöverbelastning och svåra ämnesomsättningsrubbningar skall korrigeras innan infusionen påbörjas.
Metabola komplikationer kan inträffa om näringsintaget inte anpassas efter patientens behov eller om förmågan att metabolisera något näringsämne inte utvärderas tillräckligt. Oönskade metabola effekter kan uppstå på grund av inadekvat eller överdriven näringstillförsel eller olämplig sammansättning av en blandning för en viss patients behov.
Frekventa kliniska bedömningar och laboratorieundersökningar är nödvändiga för korrekt övervakning under administrering. Dessa bör omfatta jonogram och njur- och leverfunktionstester.
Elektrolytbehoven för patienter som behandlas med lösningarna ska noggrant bedömas och övervakas, i synnerhet för elektrolytfria lösningar.
Glukosintolerans är en vanlig metabolisk komplikation hos svårt stressade patienter. Vid infusion av produkterna kan hyperglykemi, glukosuri och hyperosmolärt syndrom förekomma. Blod- och uringlukos ska övervakas rutinmässigt och för diabetiker ska insulindoseringen anpassas, om nödvändigt.
Används med försiktighet till patienter med njurinsufficiens, särskilt om hyperkalemi föreligger, på grund av risk för utveckling eller försämring av metabolisk acidos och hyperazotemi om extrarenalt avlägsnande av slaggprodukter inte utförs. Vätske- och elektrolytstatus ska övervakas noggrant för dessa patienter. Vid allvarlig njursvikt bör särskilda aminosyralösningar användas.
Försiktighet bör iaktas när Clinimix administreras till patienter med binjuresvikt.
Försiktighet skall iakttas för att undvika cirkulatorisk överbelastning, framför allt hos patienter med lungödem, hjärtinsufficiens och/eller hjärtsvikt. Vätskestatus ska övervakas noggrant.
Hos patienter med tidigare leversjukdom eller leverinsufficiens skall, förutom rutinmässiga leverfunktionstester, eventuella symtom på hyperammonemi kontrolleras.
Det är känt att lever- och gallvägssjukdomar inkluderande kolestas, leversteatos, fibros och cirrhos, som kan leda till leversvikt, liksom kolecystit och kolelitiasis kan utvecklas hos vissa patienter som får parenteral nutrition. Etiologin till dessa sjukdomar anses vara multifaktoriell och kan variera mellan olika patienter. Patienter som utvecklar onormala laboratorievärden eller andra tecken på lever- och gallsjukdomar bör tidigt bedömas av läkare kunnig inom leversjukdomar för att identifiera möjliga orsakande och bidragande faktorer och möjliga terapeutiska och profylaktiska interventioner.
Förhöjda ammoniaknivåer i blodet och hyperammonemi kan förekomma hos patienter som får aminosyralösningar. Hos vissa patienter kan detta indikera att en medfödd rubbning av aminosyrametabolismen finns (se avsnitt 4.3 i produktresumén) eller leverinsufficiens.
Ammoniaknivån i blodet bör mätas frekvent hos nyfödda och spädbarn för att upptäcka hyperammonemi, vilket kan indikera att medfödd rubbning av aminosyrametabolismen finns.
Beroende på omfattning och etiologi kan hyperammonemi kräva omedelbar intervention.
Alltför snabb infusion av aminosyror kan leda till illamående, kräkningar och frossa. I sådana fall ska infusionen avbrytas omedelbart.
Generellt bör försiktighet iakttas vid val av dos till äldre, med hänsyn till ökad frekvens av försämrad lever-, njur- eller hjärtfunktion och samtidig sjukdom eller läkemedelsbehandling.
Pediatrisk population
Ljusexponering av lösningar för intravenös parenteral nutrition, särskilt efter tillsats av spårelement och/eller vitaminer, kan ha negativa effekter på det kliniska resultatet hos nyfödda på grund av bildningen av peroxider och andra nedbrytningsprodukter. Vid användning för att behandla nyfödda och barn under 2 års ålder ska Clinimix skyddas från omgivande ljus fram till dess att administreringen är avslutad.
4. PRAKTISK INFORMATION OM FÖRBEREDELSE OCH HANTERING
Varning: Administrera endast produkten efter att förslutningen har brutits och innehållet i de båda sektionerna har blandats.
1. | 
| Öppna ytterpåsen genom att riva av från toppen. |
2. | 
| Dra av ytterpåsens framdel för att få fram Clinimix-påsen. Kasta ytterpåsen och den lilla påsen med syreabsorberaren. |
3. | 
| Lägg påsen platt på en vågrät och ren yta med handtaget framför dig. |
4. | 
| Lyft upphängningsdelen för att tömma lösningen från den övre delen av påsen. Rulla den övre delen av påsen ordentligt tills förslutningarna är helt öppna (ungefär halvvägs). |
5. | 
| Blanda genom att vända påsen upp och ned minst tre gånger. |
6. | 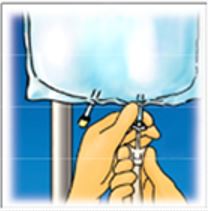
| Häng upp påsen. Vrid av skyddet från administreringsporten. Anslut spike-kontaktdonet ordentligt. |
Använd endast om lösningen är klar, färglös eller lätt gulfärgad och om påsen är oskadad.
Clinimix skall uppnå rumstemperatur före användning.
Aktivering av Clinimix kan utföras i ytterpåsen eller efter att den avlägsnats från den.
Endast för engångsbruk.
Förvara inte delvis använda påsar och kassera all utrustningen efter användning.
Återanslut inte delvis förbrukade påsar.
Får ej seriekopplas.
Vid användning för att behandla nyfödda och barn under 2 års ålder ska produkten skyddas från ljusexponering fram till dess att administreringen är avslutad. Om Clinimix exponeras för omgivande ljus, särskilt efter tillsats av spårelement och/eller vitaminer, bildas det peroxider och andra nedbrytningsprodukter, som kan minskas om produkten skyddas mot ljusexponering.
Tillsatser
Lipider, vitaminer och spårämnen bör ges till patienter som behandlas med parenteral nutrition under lång tid.
Om tillsatser är nödvändigt, ska kompatibiliteter och blandningarnas stabilitet kontrolleras.
Tillsatser kan göras efter att förslutningen öppnats (när lösningarna har blandats). Följande kan tillsättas till Clinimix:
Clinimix N9G15E
| CLINIMIX N9G15E - 1 l + 100 ml lipider 20 %* | CLINIMIX N9G15E – 1,5 l + 100 ml lipider 20 %* | CLINIMIX N9G15E – 2 l + 250 ml lipider 20 %* |
Kväve (g) | 4,6 | 6,8 | 9,1 |
Aminosyror (g) | 28 | 41 | 55 |
Glukos (g) | 75 | 113 | 150 |
Lipid (g) | 20 | 20 | 50 |
Kalorier totalt (kcal) | 610 | 815 | 1320 |
Glukoskalorier (kcal) | 300 | 450 | 600 |
Lipidkalorier (kcal) | 200 | 200 | 500 |
Glukos-/lipid-kvot | 60/40 | 69/31 | 55/45 |
Natrium (mmol) | 35 | 53 | 70 |
Kalium (mmol) | 30 | 45 | 60 |
Magnesium (mmol) | 2,5 | 3,8 | 5,0 |
Kalcium (mmol) | 2,3 | 3,4 | 4,5 |
Acetat (mmol) | 50 | 75 | 100 |
Klorid (mmol) | 40 | 60 | 80 |
Fosfat som HPO42- (mmol) | 15 | 23 | 30 |
pH | 6 | 6 | 6 |
Osmolaritet (mOsm/l) | 795 | 810 | 785 |
Clinimix N17G35E
| CLINIMIX N17G35E – 1 l + 250 ml lipider 20 %* | CLINIMIX N17G35E – 1,5 l + 500 ml lipider 20 %* | CLINIMIX N17G35E – 2 l + 500 ml lipider 20 %* |
Kväve (g) | 8,3 | 12,4 | 16,5 |
Aminosyror (g) | 50 | 75 | 100 |
Glukos (g) | 175 | 263 | 350 |
Lipid (g) | 50 | 100 | 100 |
Kalorier totalt (kcal) | 1400 | 2350 | 2800 |
Glukoskalorier (kcal) | 700 | 1050 | 1400 |
Lipidkalorier (kcal) | 500 | 1000 | 1000 |
Glukos-/lipid-kvot | 58/42 | 51/49 | 58/42 |
Natrium (mmol) | 35 | 53 | 70 |
Kalium (mmol) | 30 | 45 | 60 |
Magnesium (mmol) | 2,5 | 3,8 | 5,0 |
Kalcium (mmol) | 2,3 | 3,4 | 4,5 |
Acetat (mmol) | 75 | 113 | 150 |
Klorid (mmol) | 40 | 60 | 80 |
Fosfat som HPO42- (mmol) | 15 | 23 | 30 |
pH | 6 | 6 | 6 |
Osmolaritet (mOsm/l) | 1360 | 1290 | 1360 |
| Natrium | Kalium | Magnesium | Kalcium |
|---|
Upp till en slitlig koncentration på | 80 mmol | 60 mmol | 5,6 mmol | 3,0 mmol |
Upp till en slutlig koncentration på | Koppar | 10 µmol | Zink | 77 µmol |
Krom | 0,14 µmol | Mangan | 2,5 µmol |
Fluor | 38 µmol | Kobolt | 0,0125 µmol |
Selen | 0,44 µmol | Molybden | 0,13 µmol |
Jod | 0,5 µmol | Järn | 10 µmol |
Upp till en slutlig koncentration på | vitamin A | 1750 IE | Biotin | 35 µg |
vitamin B6 | 2,27 mg | vitamin B1 | 1,76 mg |
vitamin D | 110 IE | Folsyra | 207 µg |
vitamin B12 | 3,0 µg | vitamin B2 | 2,07 mg |
vitamin E | 5,1 mg | vitamin C | 63 mg |
Niacin | 23 mg | vitamin B5 | 8,63 mg |
vitamin K | 75 µg | | |
Stabilitetsdata för tillsatser till Clinimix av andra lipidemulsioner och andra tillsatser eller näringsämnen som finns på marknaden kan erhållas på begäran.
Om en lätt gräddliknande skiktning syns i lösningen, skall den blandas noggrant genom att varsamt skaka den för att få en homogen emulsion före infusionen.
Tillsatser ska göras under aseptiska förhållanden.
Tillsatser kan göras med en spruta eller ett överföringsaggregat.
Inkompatibiliteter
Tillsatser kan vara inkompatibla. Inhämta ytterligare information från tillverkaren.
Om tillsatser är nödvändiga ska blandningarnas kompatibilitet och stabilitet kontrolleras.
Lösningen skall inte administreras tillsammans med, före eller efter administrering av blod genom samma utrustning på grund av risken för pseudoagglutination.
Clinimix innehåller kalciumjoner vilket kan medföra risk för utfällning i citrat-antikoagulerat blod-eller blodkomponenter.
Liksom för alla parenterala nutritionsblandningar måste kalcium- och fosfatbalansen beaktas. För stora tillsatser av kalcium och fosfat, särskilt i form av mineralsalter, kan leda till att kalciumfosfatutfällningar bildas.
Liksom för andra infusionslösningar som innehåller kalcium, är samtidig behandling med ceftriaxon och Clinimix kontraindicerad hos nyfödda (≤ 28 dagars ålder), även om separata infusionsslangar används (risk för fatal utfällning av ceftriaxonkalciumsalt i den nyföddas blodomlopp).
Hos patienter äldre än 28 dagar (inkluderande vuxna), får ceftriaxon inte administreras genom samma infusionsslang samtidigt med intravenösa lösningar som innehåller kalcium, inklusive Clinimix (se avsnitt Varningar).
Om samma infusionsslang används för efterföljande administrering måste infusionsslangen spolas noggrant med en kompatibel vätska mellan infusionerna.
5. HÅLLBARHET
2 år när den förvaras i ytterpåsen.
Det rekommenderas att produkten används omedelbart efter att den icke-permanenta förslutningen mellan de två sektionerna har öppnats. Den färdigberedda lösningen (dvs. förslutningen inuti påsen har öppnats) har dock påvisats vara stabil i maximalt 7 dagar vid 2 °C-8 °C följt av maximalt 48 timmar vid högst 25 °C.
När tillsatser har gjorts skall blandningen ur mikrobiologisk synvinkel användas omedelbart efter tillsatser. Om den inte används omedelbart är förvaringstid och förvaringsförhållanden före användning användarens ansvar. Förvaringstiden skall normalt inte överstiga 24 timmar vid 2 °C-8 °C, om inte tillsatserna har skett under kontrollerade och validerade aseptiska förhållanden. Om längre förvaringstider krävs under särskilda omständigheter kan företaget kontaktas, eftersom kemiska och fysiska stabilitetsdata under användning för 7 dagar vid 2-8 °C följt av 48 timmar vid högst 25 °C finns tillgängliga för produkterna i listan i föregående avsnitt.